打开文本图片集
[摘要] 目的 探討他汀类药物对食管癌细胞增殖及蛋白激酶B(Akt)蛋白表达影响。方法 取食管鳞癌(ESCC)细胞株进行培养,以不同时间(24、48 h)和不同浓度(15、45 μmol/L)的普伐他汀、辛伐他汀进行干预(4个实验组),并设立空白对照组。分别检测各组细胞增殖和丙二醛(MDA)含量,以及辛伐他汀对细胞周期和细胞凋亡、Akt mRNA表达的影响。结果 普伐他汀、15 μmol/L辛伐他汀干预癌细胞时,对细胞增殖均无明显影响(P>0.05),45 μmol/L辛伐他汀能够显著抑制癌细胞增殖(F=5.345、16.383,P<0.05)。各浓度普伐他汀干预癌细胞时,MDA含量均无明显变化(P>0.05);各浓度辛伐他汀干预癌细胞时,MDA含量均有明显上升(F=5.913、7.435,P<0.05)。辛伐他汀干预癌细胞时,G0/G1期细胞实验组明显高于对照组,S期、G2/M期细胞实验组明显低于对照组(t=2.975~10.027,P<0.05)。各浓度辛伐他汀干预癌细胞时,Akt mRNA表达均明显下降(F=6.541、7.548,P<0.05)。结论 辛伐他汀对食管癌细胞确有抑制细胞增殖、促进细胞凋亡的作用,并能够抑制Akt蛋白的表达。
[关键词] 食管肿瘤;普伐他丁;细胞增殖;细胞凋亡;癌基因蛋白质v-Akt
[中图分类号] R735.1;R972.6 [文献标志码] A [文章编号] 2096-5532(2019)04-0434-04
[ABSTRACT] Objective To investigate the effect of statins on the proliferation of esophageal cancer cells and the expression of protein kinase B (Akt). Methods An esophageal squamous cell carcinoma (ESCC) cell line was cultured, and the cells were divided into 4 experimental groups and were treated with pravastatin or simvastatin at different concentrations (15 and 45 μmol/L). A blank control group was also set up. Cell proliferation and malondialdehyde (MDA) level were measured for all groups, and the effect of simvastatin on cell cycle, cell apoptosis, and mRNA expression of Akt was analyzed. Results Pravastatin and 15 μmol/L simvastatin had no significant effect on the proliferation of ESCC cells (P>0.05), and 45 μmol/L simvastatin significantly in-hibited the proliferation of cancer cells (F=5.345 and 16.383,P<0.05). The cancer cells treated with different concentrations of pravastatin had no significant change in MDA content (P>0.05), while those treated with different concentrations of simvastatin had a significant increase in MDA content (F=5.913 and 7.435,P<0.05). When the cancer cells were treated with simvastatin, compared with the control group, the experimental group had a significantly higher number of cells in the G0/G1 phase and a signi-ficantly lower number of cells in the S phase or G2/M phase (t=2.975-10.027,P<0.05). The cancer cells treated with different concentrations of simvastatin had a significant reduction in the mRNA expression of Akt (F=6.541 and 7.548,P<0.05). Conclusion Simvastatin can inhibit the proliferation and promote the apoptosis of esophageal cancer cells and inhibit the expression of Akt protein.
[KEY WORDS] esophageal neoplasms; pravastatin; cell proliferation; apoptosis; oncogene protein v-Akt
食管癌是常见的消化道肿瘤,每年全球约有30万人死于此病[1]。近年有多项研究表明,他汀类药物在抑制包括肺癌、肝癌、乳癌等多种肿瘤细胞生长方面有效而且安全,可使癌症风险率降低20%~30%,但对于食管癌方面的研究则少见报道[2-4]。因此,本文采用体外细胞实验的方式,培养食管鳞癌(ESCC)细胞株并采用他汀类药物进行干预,取其亲水型代表普伐他汀和亲脂型代表辛伐他汀做对照研究,探讨他汀类药物对食管癌细胞增殖及蛋白激酶B (Akt)蛋白表达影响。现将结果报告如下。
1 材料和方法
1.1 实验材料
人类ESCC细胞株DC875(上海泽叶生物科技有限公司,来源库:ATCC);辛伐他汀(CAS 79902-63-9,上海士锋生物科技有限公司);普伐他汀(CAS 81131-70-6,上海谱振生物科技有限公司)。CCK-8试剂及试剂盒(同仁化学研究所,日本);FACS Calibur流式细胞仪(Becton Dickinson,USA);丙二醛 (MDA)试剂盒(南京建成生物工程研究所);逆转录试剂盒、荧光定量PCR试剂和试剂盒(北京诺博莱德科技有限公司)。
1.2 实验方法
1.2.1 细胞培养 EAC细胞株和ESCC细胞株常规培养于RPMI 1640培养基中,取对数生长期细胞进行实验检测。
1.2.2 细胞增殖实验 将对数生长期的细胞样本根据干预时间设立24、48 h干预培养板。各板样本再根据采用普伐他汀、辛伐他汀干预分为两组,每组内设15、45 μmol/L两种浓度,包括15 μmol/L普伐他汀组(B组)、45 μmol/L普伐他汀组(C组)、15 μmol/L辛伐他汀组(D组)、45 μmol/L辛伐他汀(E组),同时设空白对照组(对照组,A组),每组含两个复孔。采用CCK-8试剂盒检测细胞增殖。实验重复5次,统计增殖平均值。
1.2.3 MDA检测 按照MDA试剂盒的使用说明进行操作,记录吸光度值。同时,采用BCA蛋白浓度测试试剂盒(碧云天生物技术研究所)测定样本蛋白浓度。
1.2.4 细胞周期和细胞凋亡检测 采集45 μmol/L浓度辛伐他汀处理的细胞样本液,使用FACS Calibur流式细胞仪检测细胞周期及凋亡率。
1.2.5 Akt mRNA检测 取对照组及45 μmol/L辛伐他汀药物处理24、48 h的细胞样本液,采用荧光定量PCR对Akt基因进行扩增。
1.3 評价指标
本研究评价的指标包括:①细胞增殖吸光度变化;②MDA含量[5-6]; ③细胞周期各期的占比以及凋亡率;④Akt mRNA含量。
1.4 统计学分析
采用SPSS 17.0统计学软件进行统计学分析。采用2×2×2析因设计的方差分析,比较不同他汀类药物浓度和作用时间对细胞增殖的影响及交互作用;采用2×2析因设计方差分析,比较他汀类药物对MDA含量的影响,以及辛伐他汀对Akt mRNA含量的影响及交互作用;采用两独立样本t检验,比较辛伐他汀对细胞周期及凋亡率的影响。检验水准α=0.05。
2 结 果
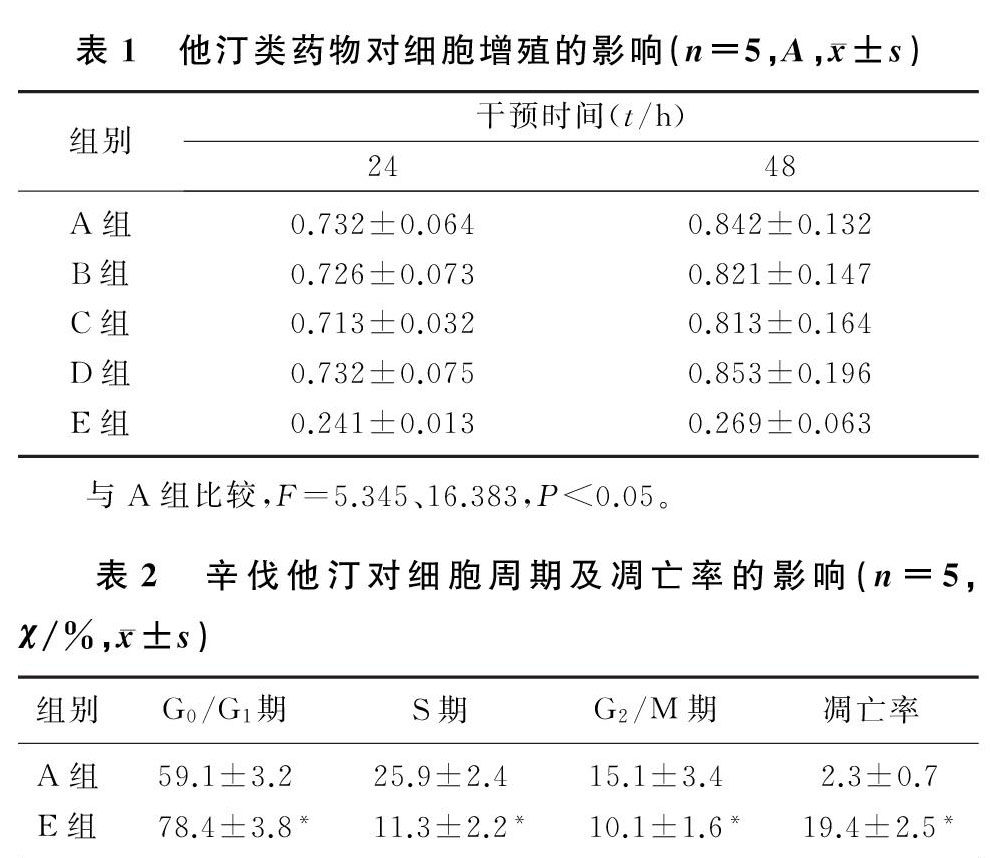
2.1 他汀类药物对细胞增殖的影响
与空白对照组相比较,在15 μmol/L普伐他汀和辛伐他汀、45 μmol/L普伐他汀干预癌细胞时,均对细胞增殖无明显影响(P>0.05);而辛伐他汀在45 μmol/L浓度时,能够显著抑制癌细胞增殖(F=5.345、16.383,P<0.05)。析因设计的方差分析显示,不同药物有交互作用(F药物=9.435,P<0.05),不同浓度有交互作用(F浓度=6.674,P<0.05),不同时间有交互作用(F时间=4.687,P<0.05),浓度与时间没有交互作用(P>0.05)。见表1。
2.2 他汀类药物对MDA含量的影响
A~E组MDA含量分别为1.73±0.16、1.75±0.21、1.74±0.18、2.63±0.36、7.61±1.15。与空白对照组相比,各浓度普伐他汀干预癌细胞时,MDA含量均无明显变化(P>0.05);各浓度辛伐他汀干预癌细胞时,MDA含量均有明显上升(F=5.913、7.435,P<0.05)。析因设计的方差分析显示,不同药物有交互作用(F药物=4.687,P<0.05),不同浓度有交互作用(F浓度=7.635,P<0.05),浓度与时间没有交互作用(P>0.05)。
2.3 辛伐他汀对细胞周期及凋亡率的影响
与对照组相比,45 μmol/L辛伐他汀干预癌细胞时,G0/G1期实验组明显高于对照组,S期、G2/M期实验组明显低于对照组(t=2.975~10.027,P<0.05)。实验组细胞凋亡率明显高于对照组(t=14.278,P<0.05)。见表2。
2.4 辛伐他汀对Akt mRNA表达的影响
15 μmol/L辛伐他汀干预24、48 h细胞的Akt mRNA含量分别为74.32±8.21、63.47±7.13,45 μmol/L辛伐他汀干预24、48 h分别为60.15±7.43、27.43±2.98。各浓度辛伐他汀在干预癌细胞不同时间时,Akt mRNA含量均有明显下降(F=6.541、7.548,P<0.05)。析因设计的方差分析显示,不同时间有交互作用(F时间=5.617,P<0.05),不同浓度有交互作用(F浓度=5.617,P<0.05),浓度与时间有交互作用(F时间╳浓度=1.056,P<0.05)。
3 讨 论
他汀类药物属于HMG-CoA还原酶抑制剂,除了能够强效地降低总胆固醇和低密度脂蛋白(LDL) 以外,还能够在一定程度上提升高密度脂蛋白的水平[7-9]。国内有研究显示,他汀类药物对白血病细胞有诱导凋亡的作用,可以降低肿瘤细胞转移和侵袭的能力,其机制可能与Akt蛋白信号通路有关[10]。Akt是一种丝氨酸-苏氨酸蛋白激酶,为PI3K通路的下游信号分子,而PI3K通路在体内负责多种细胞的增殖代谢,其可以抵抗细胞凋亡,在癌细胞的增殖中起重要作用[11-13]。本文选取他汀类药物亲水型代表普伐他汀和亲脂型代表辛伐他汀作为干预药物,观察其对于ESCC细胞株的增殖和凋亡的影响并探讨其机制。
本文研究结果显示,辛伐他汀只有在高浓度下(45 μmol/L)对于细胞增殖的抑制较为明显。这提示我们辛伐他汀对于食管癌细胞的增殖抑制存在浓度依赖性,而亲水型的普伐他汀对细胞增殖则无明显的抑制作用[14-17]。一项关于癌细胞的体外培养研究显示,亲脂型的辛伐他汀在一定浓度基础上可发挥对肿瘤细胞的抑制作用,而普伐他汀则无明显影响[18]。其机制可能与其通过细胞膜的方式有关,亲水性的药物分子更难透过磷脂双分子层到达细胞核[19-21]。但与临床试验不同,细胞实验并不能完全模拟人体通过正常代谢途径后对药物渗透性产生的额外作用。因此,尚不能断言亲水型的普伐他汀对于人体的食管癌细胞的增殖无作用[22]。另外,本文结合文献分析,亲水型的他汀类药物不能发挥作用可能与食管癌细胞表面缺乏相应的有机阴离子转运缩氨酸(OATP1B1)通道有关,后期通过进一步检测食管癌细胞上的OATP1B1通道分布情况,该检测可以作为证明亲水型他汀类药物不能发挥相应作用的可靠方法[24]。
由于对细胞代谢的分子难以逐个分析,故本文选取MDA作为细胞氧化损伤的代表指标[23-25],检测其细胞生物学功能。结果表明,各浓度辛伐他汀干预癌细胞时,MDA含量均有明显上升。提示辛伐他汀干预后癌细胞出现了过氧化损伤,且呈浓度依赖性。结合之前细胞增殖的结果,可以认为普伐他汀并未真正进入细胞内部发挥作用[26]。同时,推测过氧化杀伤是抑制细胞增殖的机制之一。本文辛伐他汀干预对细胞周期影响的结果显示,ESCC细胞阻滞于G0/G1期,与国外的研究结果相符[27]。
Akt蛋白通路在肿瘤细胞的增殖凋亡方面起到重要作用。对于一些研究显示他汀类药物可调节通路Akt蛋白的表达[28],本文也进行了论证。结果表明,不同浓度和不同时间辛伐他汀干预癌细胞时Akt mRNA含量均明显下降,且呈浓度依赖性。显示了他汀类药物在抑制肿瘤细胞增殖、诱导其凋亡方面的新研究方向。然而,关于他汀类药物的副作用以及对于食管癌预后是否存在负面影响,则需要进一步的临床研究证实。
[参考文献]
[1] 乔友林. 食管癌流行病学研究的重要里程碑[J]. 中国肿瘤临床, 2016,43(12):500-501.
[2] 陶可胜,黄蕾. 食管癌的流行病学和控制策略[J]. 中国社区医师, 2012,28(9):5.
[3] 马丹,杨帆,廖专,等. 中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)[J]. 胃肠病学, 2015,35(4):220-240.
[4] 金春亭,鲁蓓,李海军,等. 环氧化酶-2选择性抑制剂抑制人食管癌细胞的生长及其诱导凋亡[J]. 世界华人消化杂志, 2007,15(5):440-446.
[5] 李丽斌,庄则豪. 他汀类药物的抗癌作用与食管癌防治[J]. 胃肠病学, 2013,18(8):493-496.
[6] 鄭刚. 他汀类药物抗肿瘤的作用机制及临床研究进展[J]. 世界临床药物, 2017,38(4):230-235,271.
[7] 刘青,夏洪伟,刘毕胜,等. 他汀类药物对消化系统肿瘤作用的临床研究进展[J]. 现代生物医学进展, 2016,16(17):3389-3393.
[8] 卢红,王建军,周芳. 食管鳞癌组织中磷酸化表皮生长因子受体和Akt蛋白的表达[J]. 郑州大学学报(医学版), 2015,50(1):5-8.
[9] 费洪新,张晓杰,张英博. 辛伐他汀对胰腺癌BxPC-3细胞株Shh相关蛋白的影响[J]. 中国老年学杂志, 2017,37(9):2081-2084.
[10] 符少娘. 辛伐他汀和PPI联用对Barrett食管的预防效果及其安全性分析[J]. 现代医学, 2016,44(12):1718-1721.
[11] 王军杰,田宇,徐开林,等. 他汀类药物通过抑制Akt通路调控急性T淋巴细胞白血病细胞增殖与凋亡[J]. 中国实验血液学杂志, 2018,26(2):359-367.
[12] 叶强,陈良海,刘应才,等. 辛伐他汀通过Akt/GSK3β通路抑制心肌梗死后心肌细胞凋亡[J]. 中国药理学通报, 2011,27(12):1656-1660.
[13] 李月白,胡新永,王义生. 地塞米松和辛伐他汀对成骨细胞增殖分化的影响[J]. 郑州大学学报(医学版), 2006,41(6):1072-1075.
[14] 刘春伟,丛洪良,于雪芳,等. PI3K-Akt、mito-K_(ATP)通道及mPTP在阿托伐他汀后处理减轻大鼠心肌缺血再灌注损伤中的作用[J]. 天津医药, 2015,43(1):46-50.
[15] 高宏. 他汀类药物与肝细胞癌发病风险相关性研究的Meta分析[D]. 重庆: 重庆医科大学, 2013.
[16] 刘爱旗,夏璐. CCK-8法与MTT法检测兔成纤维细胞活性的比较研究[J]. 中国医学创新, 2013,10(2):12-13.
[17] 彭珍桂,卢小玲. MTT法和CCK-8法检测人肝癌细胞活性的对比研究[J]. 生物技术世界, 2016,10(3):319.
[18] 张宁,赵彩彦. 他汀类药物对肝细胞癌的作用及机制研究进展[J]. 实用肝脏病杂志, 2015,18(3):329-332.
[19] 李晓军,梁力建,吴宝安. 普伐他汀对肝癌血管形成的抑制作用[J]. 华夏医学, 2008,21(6):1062-1064.
[20] 赫捷,邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J]. 中国癌症杂志, 2011,21(7):501-503.
[21] 李文军. 大蒜素和辛伐他汀对肺癌A549细胞凋亡和增殖抑制的研究[D]. 济南: 山东大学, 2013.
[22] 郑龙志,陈有挺,石铮. 阿伐他汀诱导人胆管癌QBC939细胞凋亡的研究[J]. 江西医药, 2012,47(6):480-482.
[23] 张思维,张敏,李光琳,等. 2003—2007年中国食管癌发病与死亡分析[J]. 中国肿瘤, 2012,21(4):241-247.
[24] 黄子初,蒲荣. 血清CEA,SCC和CYFRA21-1在食管癌早期诊断中的应用价值[J]. 当代医学, 2011,17(4):115-116.
[25] 陈玲,王长青,刘政. 药物对Barrett食管恶性进展的化学预防作用[J]. 国际消化病杂志, 2015,35(6):371-374.
[26] 房志卿. 辛伐他汀与氯化两面针碱对肾癌抑制作用及其机制的研究[D]. 济南: 山东大学, 2014.
[27] 林志鑫,傅君舟,梁鸣,等. 辛伐他汀对高糖培养肾小球系膜细胞增殖和细胞周期的影响及机制[J]. 重庆医学, 2016,45(1):24-26.
[28] 金迎迎,包兴,柯悦,等. 辛伐他汀通过调控PI3K/AKT通路介导的EMT参与放疗诱导的食管癌细胞耐受[J]. 西安交通大学学报(医学版), 2019,40(1):32-37.
(本文编辑 于国艺)
扩展阅读文章
推荐阅读文章
花田文秘网 https://www.huatianclub.com
Copyright © 2002-2018 . 花田文秘网 版权所有